Как правильно составлять ионные уравнения для сильных и слабых веществ: практические советы
Ионные уравнения играют важную роль в химии, поскольку они помогают точно понять, как вещества взаимодействуют на молекулярном уровне. Важно учитывать различия между сильными и слабыми электролитами, чтобы правильно составить ионные уравнения и понять их поведение в растворе. На этой странице вы найдете полезные советы по составлению и анализу таких уравнений, которые помогут вам разобраться в этом ключевом аспекте химии.


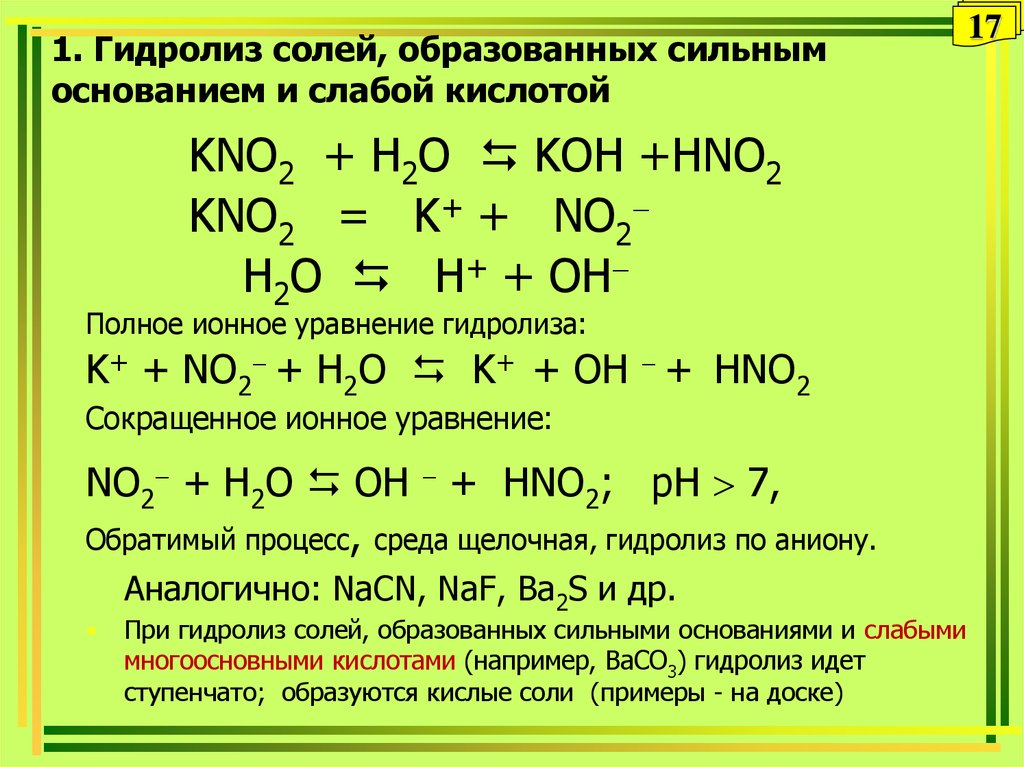
При составлении ионных уравнений важно учитывать, что сильные электролиты полностью диссоциируют в растворе, в отличие от слабых, которые частично диссоциируют.

РЕАКЦИИ ИОННОГО ОБМЕНА и условия их протекания - Как составлять молекулярные и ионные уравнения


Для слабых электролитов в ионных уравнениях нужно оставлять их в молекулярной форме, поскольку они не диссоциируют полностью.

Ионные уравнения реакций. Как составлять полные и сокращенные уравнения

Не забывайте указывать ионы, участвующие в реакции, и исключать из уравнения ионы, не меняющиеся в процессе реакции.

Сильные и слабые электролиты - Химия с Сашей Сильвер - ЕГЭ 2024 - SMITUP

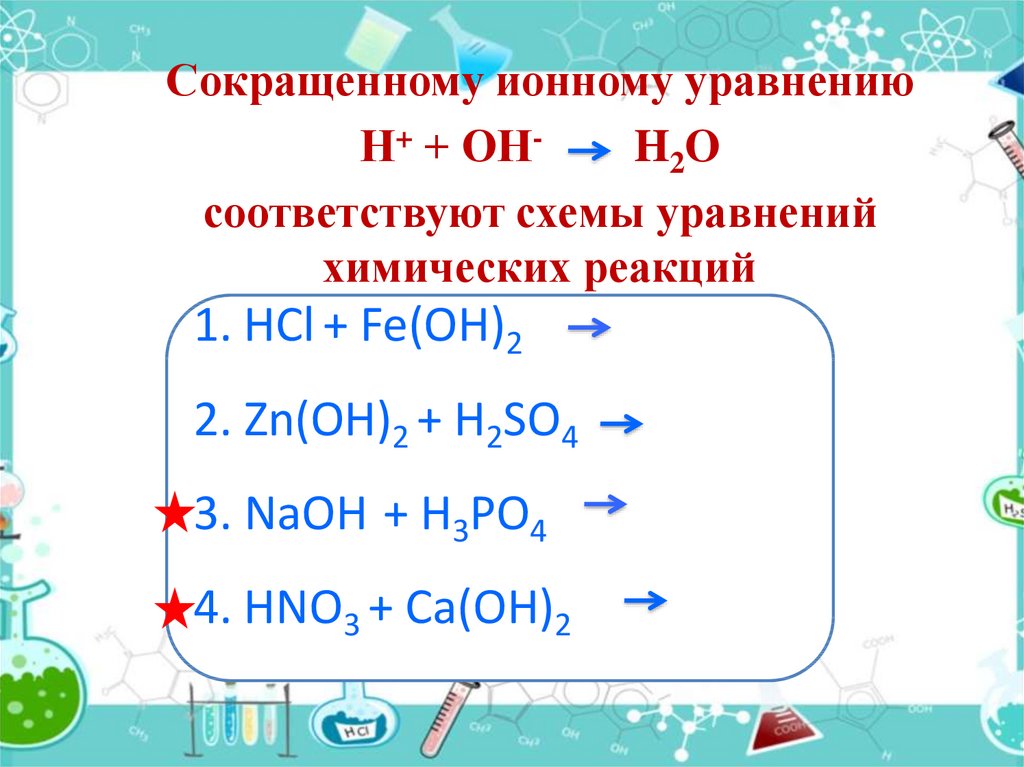
При написании полного ионного уравнения всегда используйте коэффициенты, чтобы уравнение сохраняло баланс по числу атомов и зарядов.

Покупки бытовой likerkacinema.ruрь-декабрь2024.
Проверяйте, чтобы все ионы были правильно обозначены, включая их заряд и фазовое состояние (например, твердый, жидкий или газообразный).

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIV

При решении задач на ионные уравнения учитывайте концентрацию растворенных веществ, так как она может повлиять на степень диссоциации.

Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.
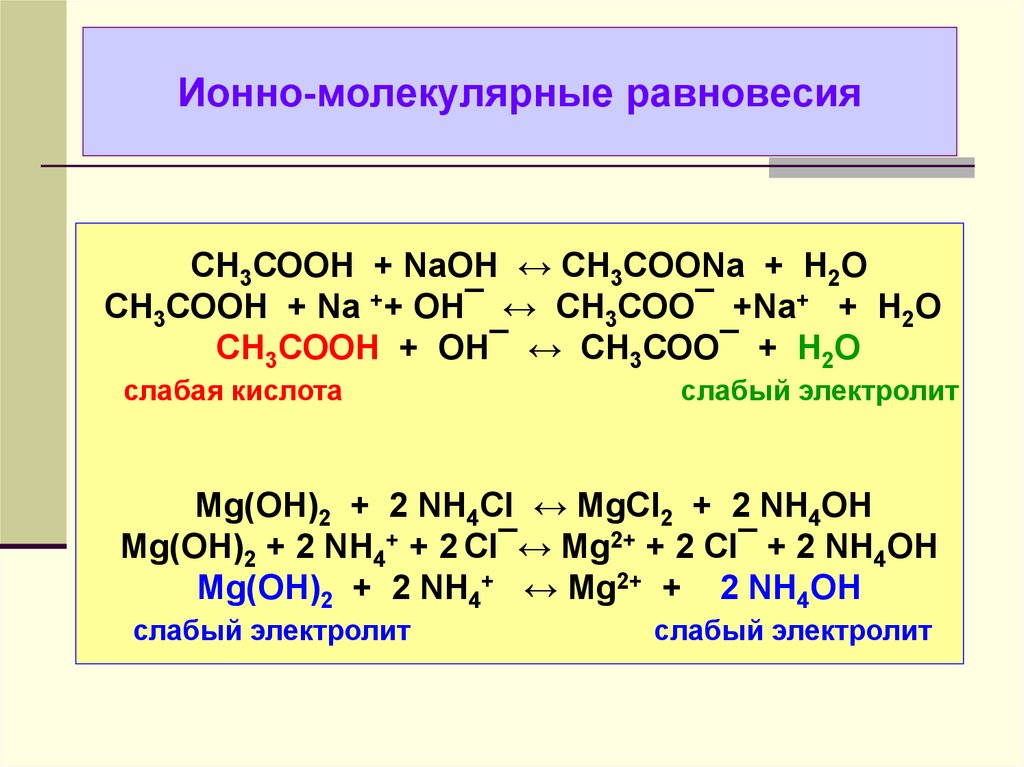

Ионные уравнения для слабых кислот и оснований нужно составлять с учетом их слабой диссоциации, где лишь небольшая часть молекул распадается на ионы.

Химия - Молекулярные и ионные уравнения

Важно помнить, что для сильных электролитов ионные уравнения часто можно записывать в виде упрощенных уравнений, исключая молекулы растворителей и неактивные ионы.

Задание 13: Все про электролитическую диссоциацию на ОГЭ
При составлении уравнений для реакций осаждения следует четко обозначать осадок и учитывать растворимость вещества в воде.
Электролитическая диссоциация кислот, оснований и солей. 9 класс.


Для реакций обмена, в которых участвуют слабые и сильные электролиты, важно правильно разделить ионы на те, которые реагируют, и те, которые остаются в растворе.

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по Химии