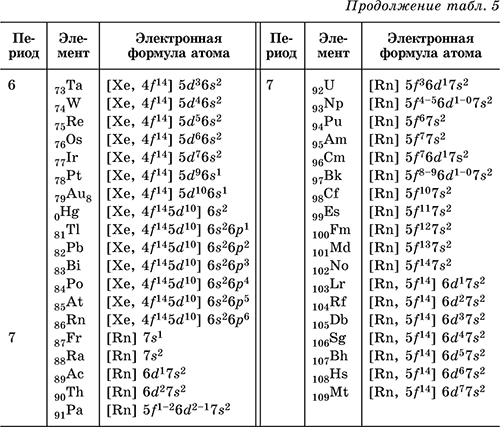
Как взаимодействуют электроны в S, P и D орбиталях элементов таблицы Менделеева
В этой статье рассматривается, как электронная конфигурация элементов в таблице Менделеева влияет на их химические свойства, а также объясняются особенности орбиталей S, P и D, что поможет лучше понять периодичность элементов и их поведение в химических реакциях.

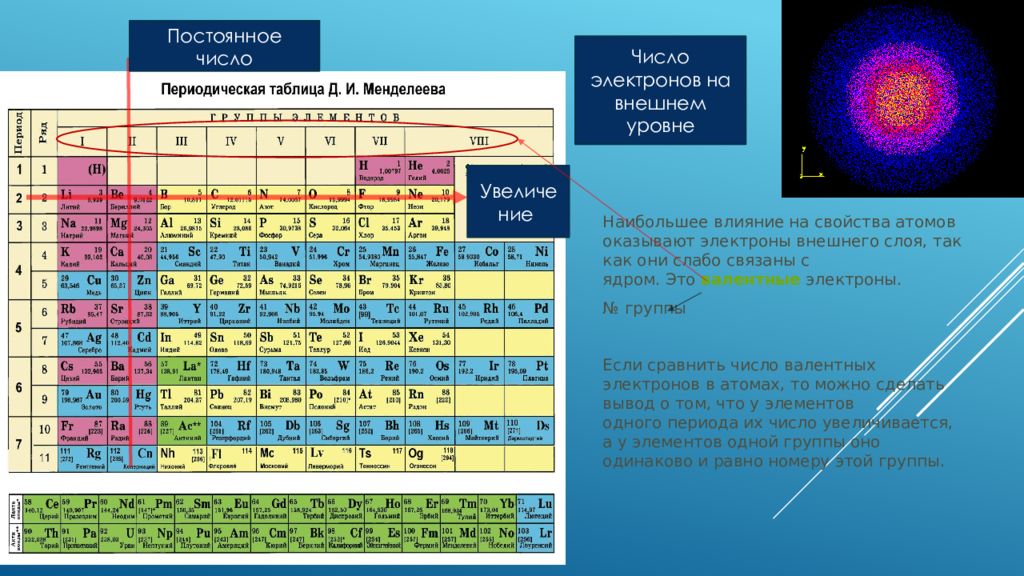
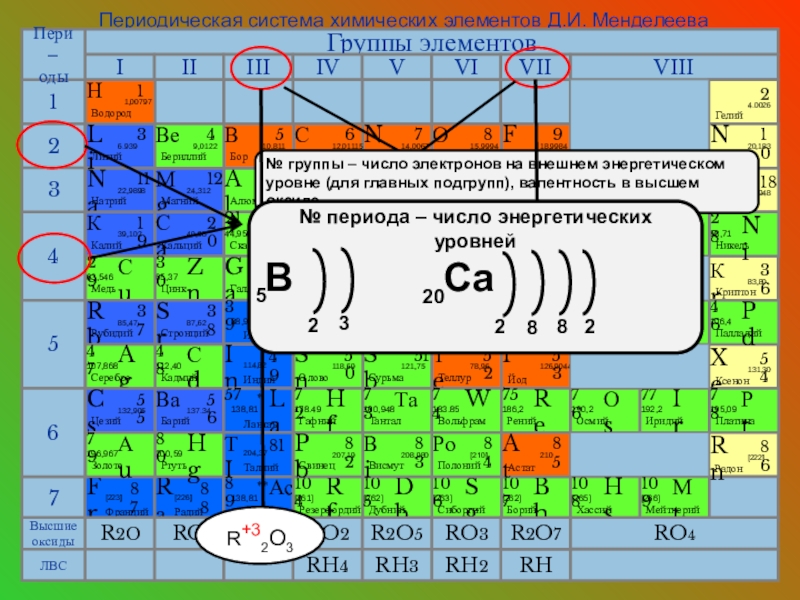
Обратите внимание на то, что элементы с заполненными S- и P-орбиталями в основном не образуют ковалентные связи с высокой энергетической отдачей.

Правила заполнения электронной конфигурации - Химия ОГЭ 2023 - Умскул


Заполняйте орбитали с учетом принципа минимальной энергии: сначала заполняются S-орбитали, затем P, а после них D.

Строение атома, электронные конфигурации - Химия ЕГЭ для 10 класса - Умскул
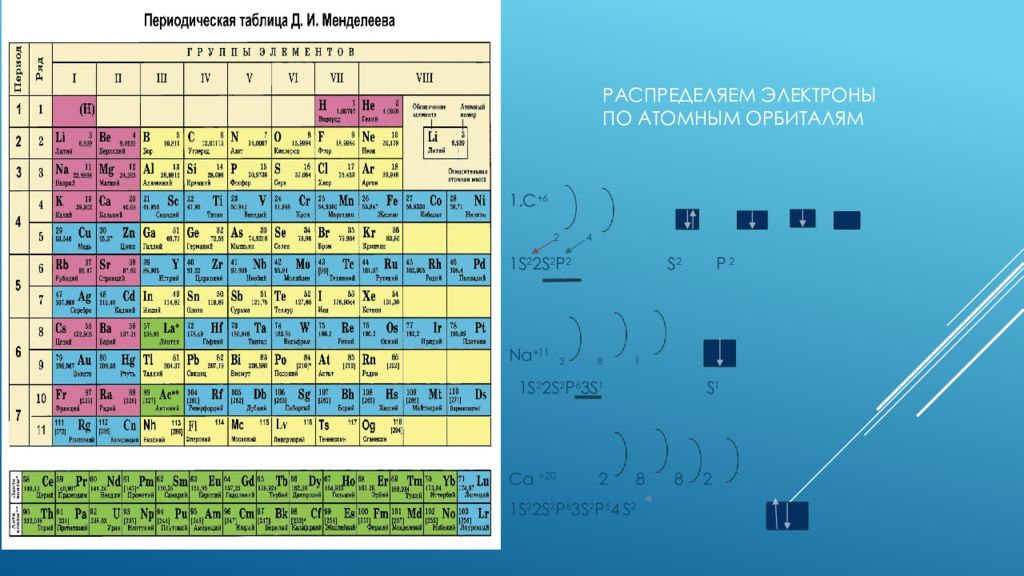

При изучении химических свойств элементов помните, что переходные металлы часто используют D-орбитали для образования химических связей.

⚠️ Из чего на самом деле состоит электрон?
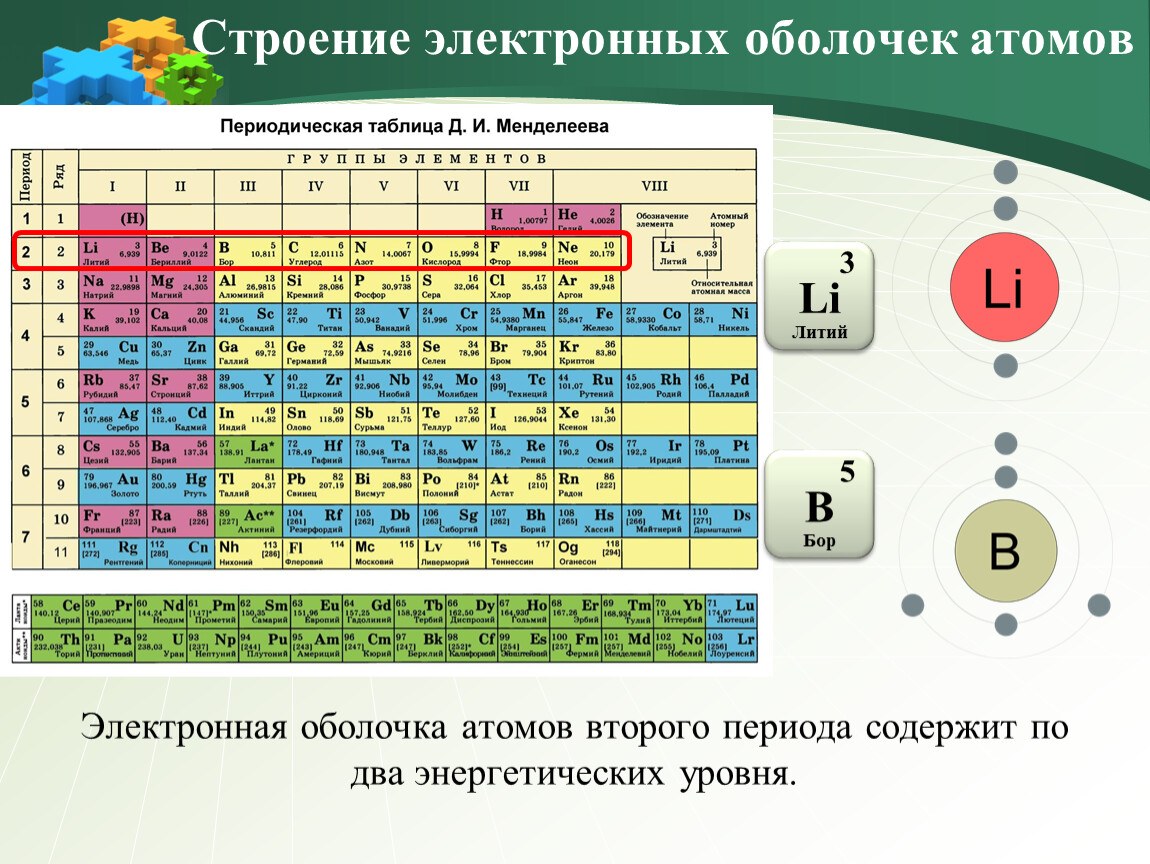
Изучая химические реакции, учитывайте, что элементы с неполными P-орбиталями могут быть более реакционноспособными, чем элементы с полностью заполненными орбиталями.

Строение атома. Как составить электронную и электронно-графическую формулы?
Орбитали S обладают сферической симметрией, что влияет на их взаимодействие с другими атомами в молекуле.

СТРОЕНИЕ АТОМА ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIV
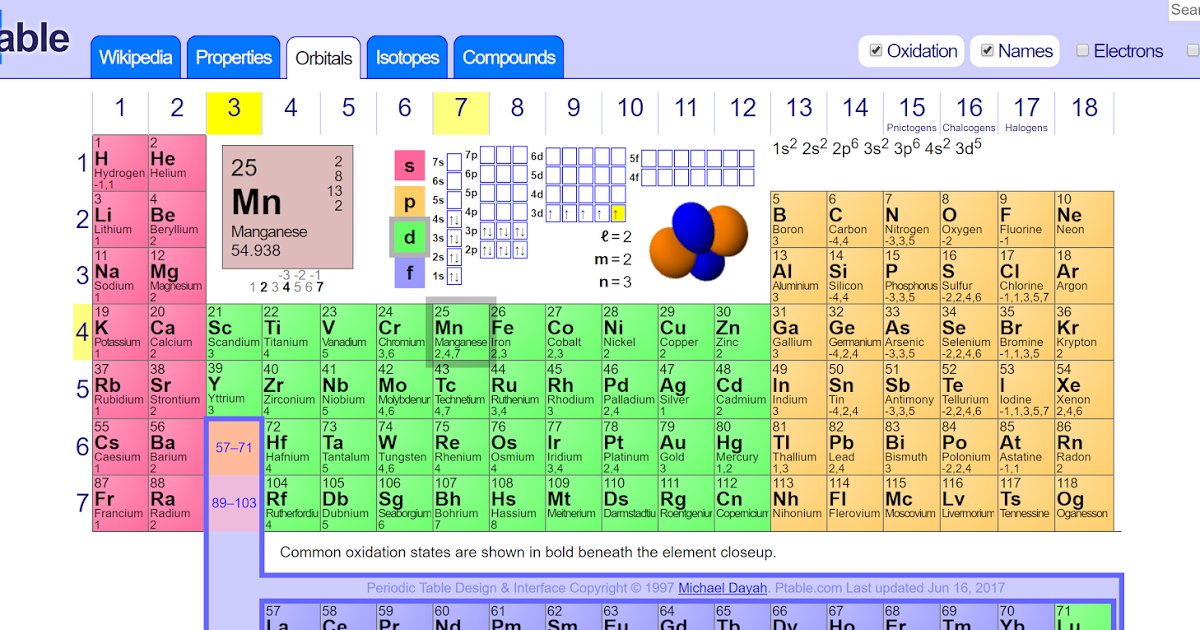
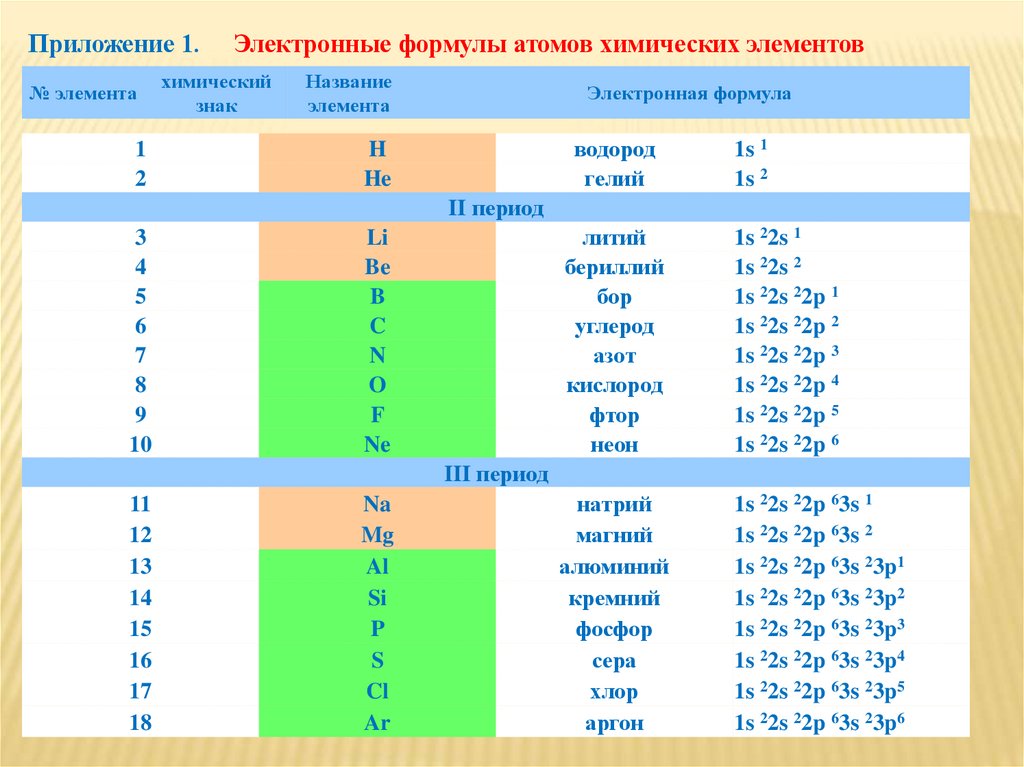
Важно учитывать, что степень окисления элементов с заполненными D-орбиталями может быть переменной, что делает их химические свойства разнообразными.
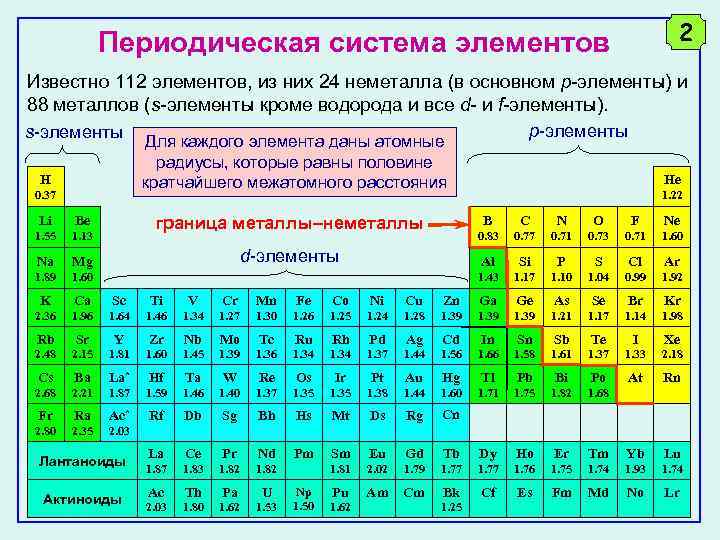
В периодической таблице элементы с подобной электронной конфигурацией имеют схожие химические и физические свойства, что позволяет предсказать их поведение в реакциях.
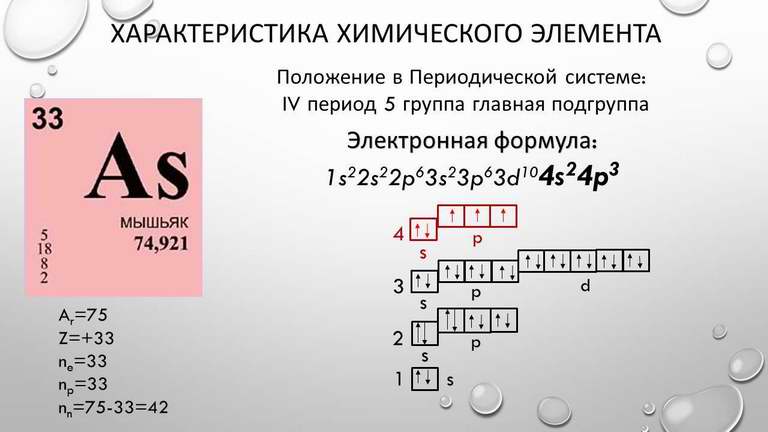
При анализе спектров поглощения энергии важно помнить, что электроны в D-орбиталях часто участвуют в переходах, связанных с высокими энергетическими уровнями.
Элементы с заполненными S-орбиталями, как правило, инертны, и их реакционная способность ограничена.
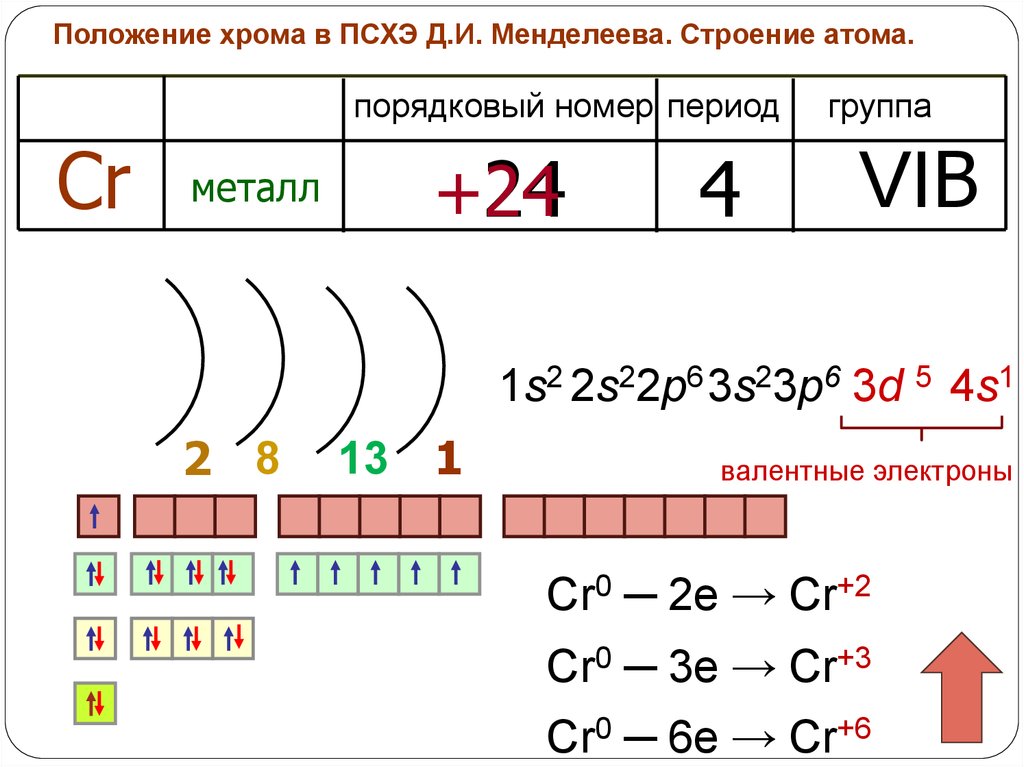
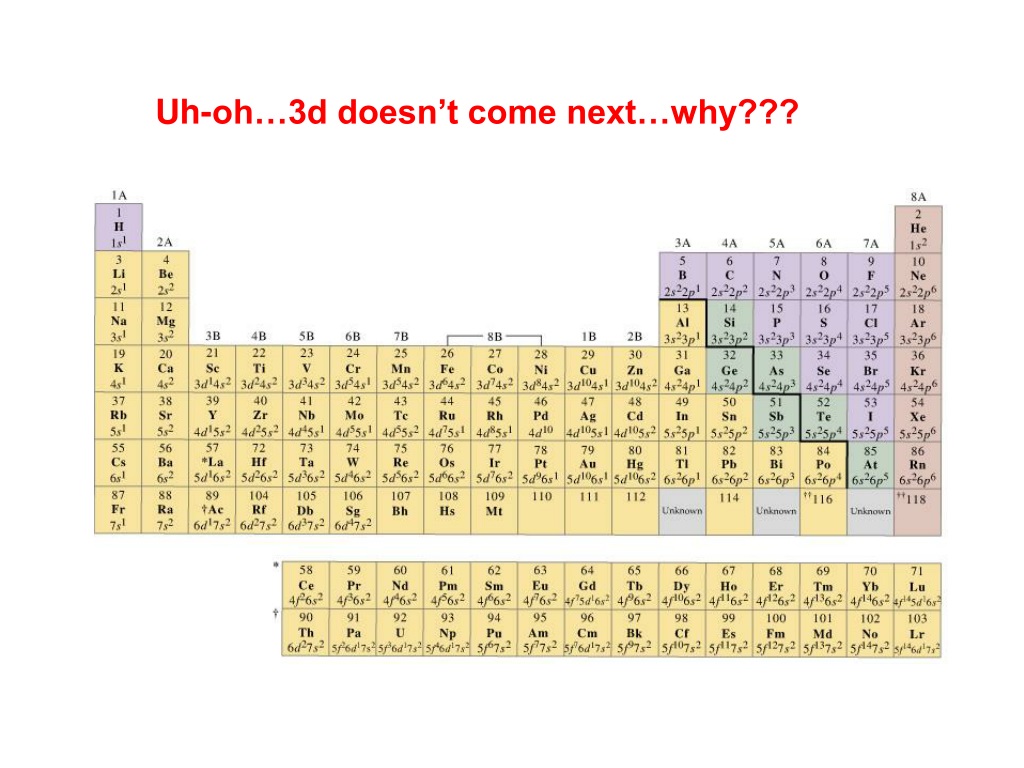
Для точного понимания химических свойств элементов важно учесть не только количество электронов в орбиталях, но и их распределение по уровням.