Как рассчитать произведение концентраций ионов: простое объяснение формулы и примеры
Произведение концентраций ионов — важный параметр в химии, используемый для определения состояния равновесия в растворах. Эта формула позволяет вычислить концентрацию ионов в различных химических реакциях, особенно в водных растворах кислот и оснований. В этом разделе представлены полезные советы и практические рекомендации по расчету этого показателя.


Для расчета произведения концентраций ионов используйте стандартную формулу для произведения концентраций ионов водородных и гидроксидных ионов в воде (Kw).
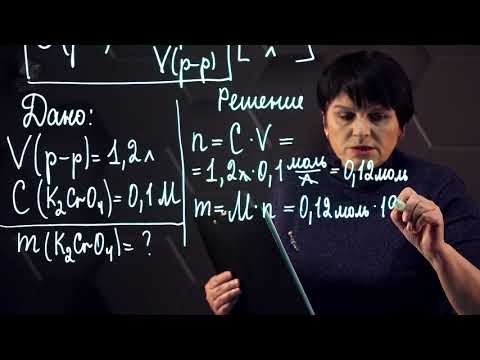
Молярная концентрация. 10 класс.

Если pH раствора известен, вы можете вычислить концентрацию ионов водорода, используя формулу [H+] = 10^(-pH).
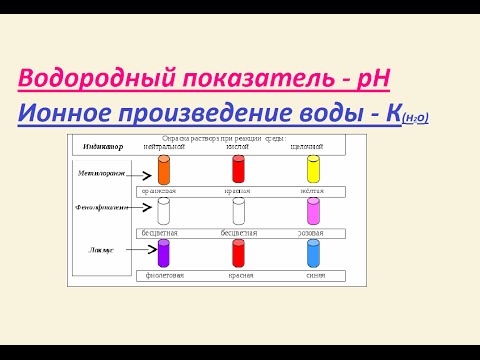
Водородный показатель - pH. Ионное произведение воды.

При расчете произведения концентраций ионов не забывайте учитывать, что в нейтральной воде произведение [H+][OH-] всегда равно 10^-14 при 25°C.

Расчет рН растворов сильных и слабых кислот. Химия для поступающих.

Если в растворе присутствуют кислоты или основания, необходимо учесть их диссоциацию для точного расчета произведения концентраций ионов.
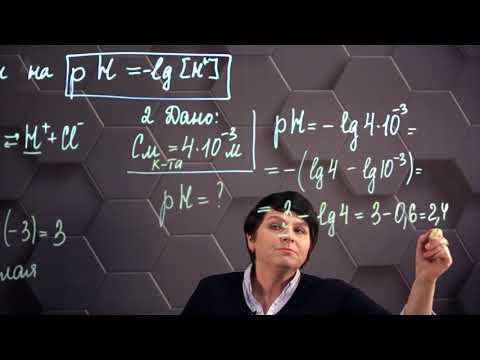
Примеры решения задач на водородный показатель pH растворов. 11 класс.

Используйте таблицы кислотности и основные константы для более точных расчетов при работе с слабыми кислотами и основаниями.

Задача на произведение растворимости ПР=[Ag+]2[CrO4(2-)]

Обратите внимание на влияние температуры на значение произведения концентраций ионов, так как это может изменяться с изменением температуры раствора.

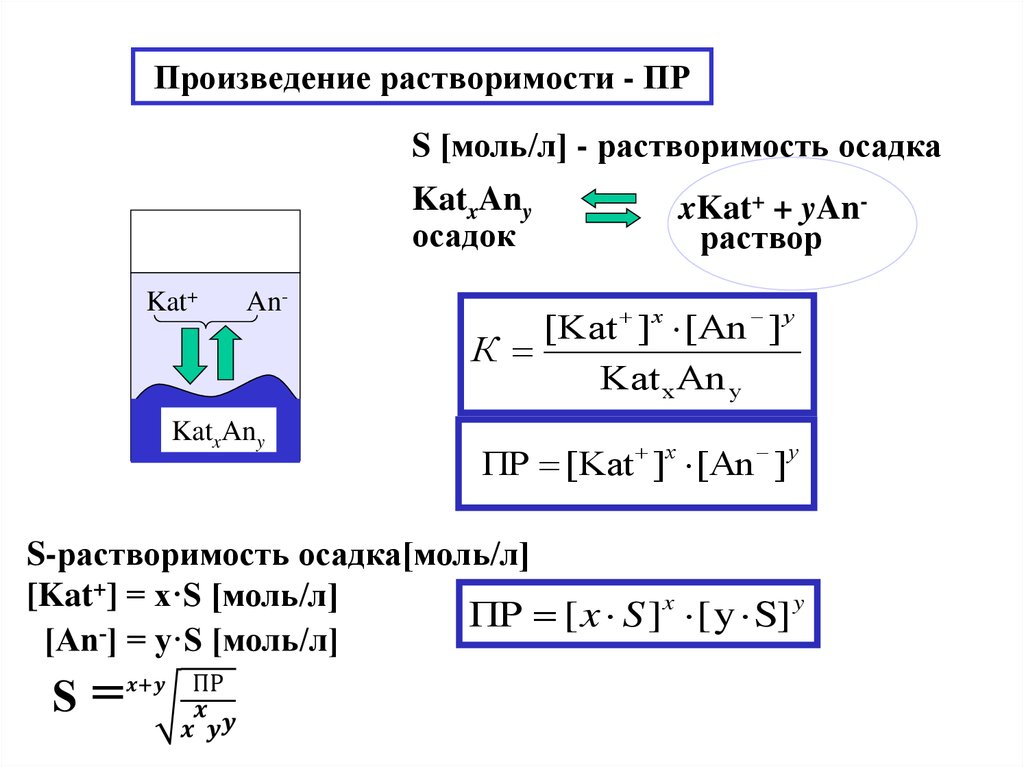
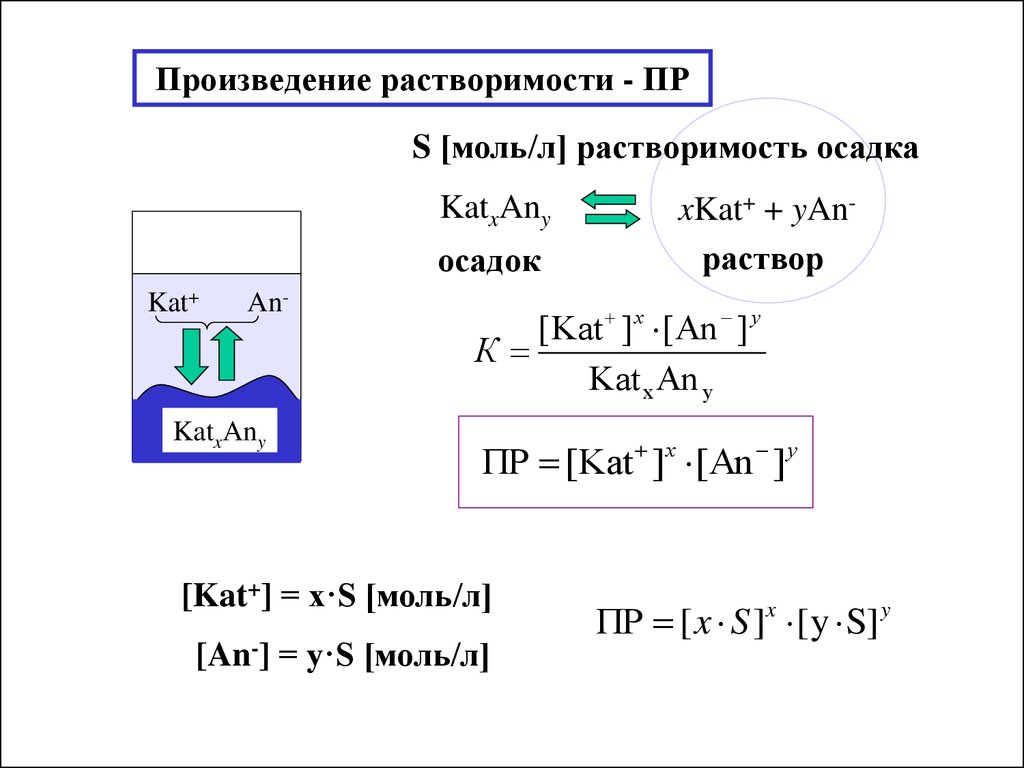
Произведение растворимости

Если известна концентрация одного из ионов, другой ион можно найти с помощью произведения, используя формулу [OH-] = Kw / [H+].

Произведение растворимости (ПР или Ksp)


Для кислотных растворов [H+] будет больше, чем [OH-], а для щелочных растворов — наоборот.

Растворимость и образование сложных ионов (видео 7)- Произведение Растворимости - Химия

Произведение растворимости (ПР). Растворимость солей в растворах.
Помимо pH, можно также использовать pOH для определения концентрации гидроксид-ионов в растворе.

Для более сложных растворов, включающих несколько видов ионов, учитывайте суммарное произведение концентраций всех ионов в соответствии с принципом сохранения массы и заряда.

