Основные методы вычисления массы вещества и его молекулярной массы
На этой странице представлены полезные советы и методы расчёта массы вещества, включая такие важные аспекты как молекулярная масса, численные значения и практическое применение формул в химии.


Для правильного расчёта массы вещества используйте формулу: масса = количество вещества × молекулярная масса.

Молярная масса. 8 класс.

Помните, что единицы измерения массы вещества обычно выражаются в граммах или килограммах, в зависимости от масштаба задачи.

Количество вещества. Моль. Число Авогадро. 8 класс.
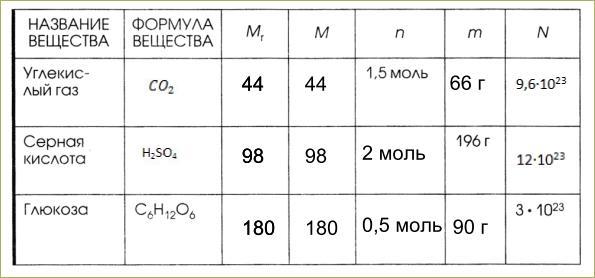
Важно учитывать, что масса вещества зависит от его молекулярной массы и количества вещества, которое можно выразить в молях.

Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон Авогадро

Для того чтобы найти молекулярную массу вещества, сложите атомные массы всех элементов, входящих в его состав.

Количество вещества. Моль. Число Авогадро. Молярная масса и молярный объем газов - Химия 8 класс
Не забывайте, что при решении задач по химии всегда нужно использовать правильные коэффициенты и соблюдение законов сохранения массы.

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный Объем
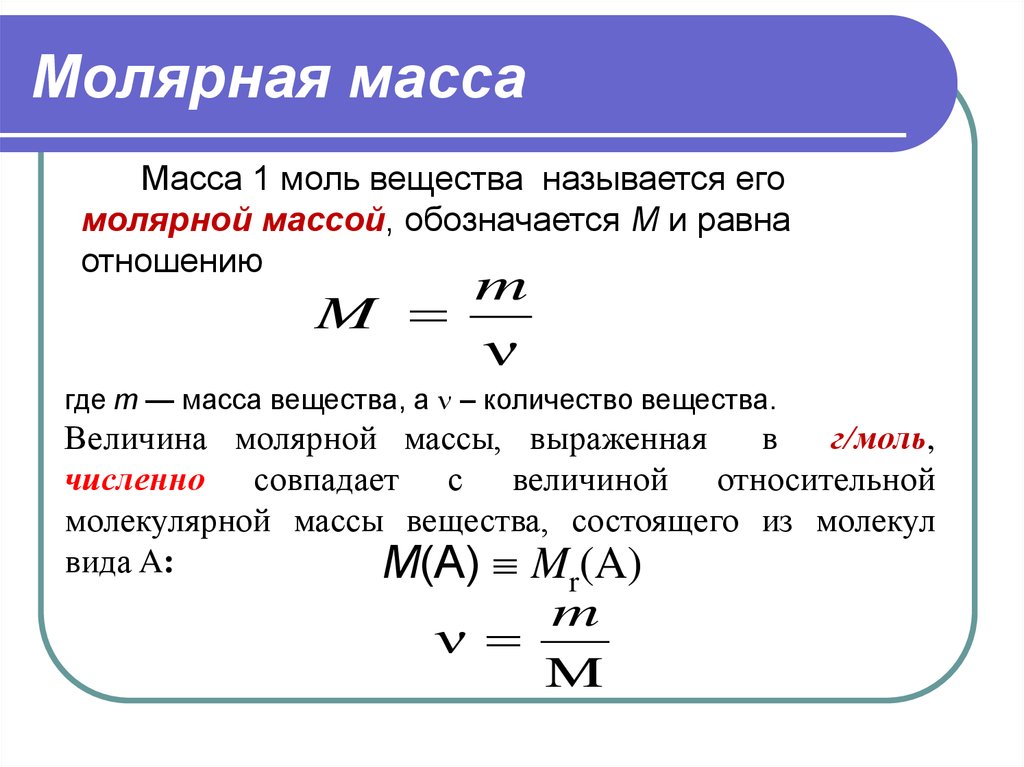

Обратите внимание на то, что при переводе массы вещества из одной системы единиц в другую, необходимо использовать соответствующие коэффициенты преобразования.


Если вы не уверены в численных значениях, воспользуйтесь таблицей атомных масс элементов для точных расчетов.

Для вычислений количества вещества в молях используйте универсальную формулу: количество вещества = масса вещества / молекулярная масса.

ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую Долю

Ешьте эти 7 продуктов после 50 для здоровья и долголетия🙌


В задачах с растворами масса вещества может зависеть от концентрации, поэтому учитывайте такие параметры как мольность или нормальность раствора.

МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная Масса


Не забывайте, что точность ваших расчетов всегда зависит от правильности применения формул и единиц измерений.

