Формулы и примеры для уравнений скорости второго порядка
Уравнение скорости реакции второго порядка помогает предсказать, как концентрации реагентов изменяются со временем. На этой странице вы найдете полезные советы и примеры расчетов, которые помогут глубже понять эту тему.
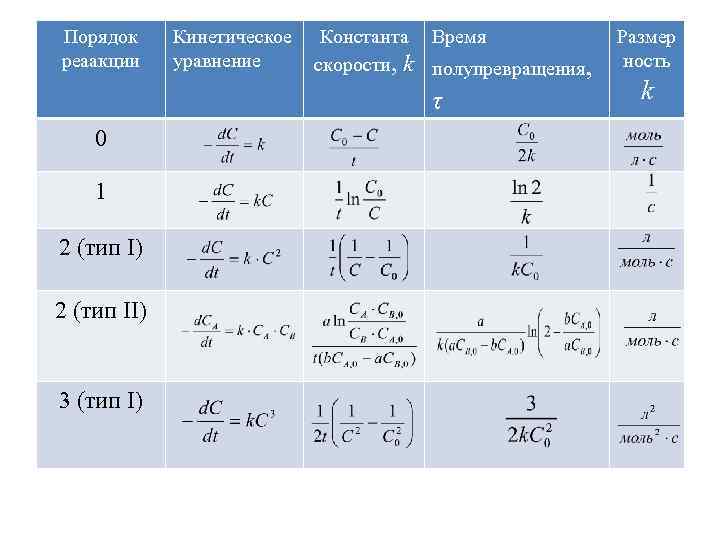

Определите порядок реакции, основываясь на экспериментальных данных о скорости и концентрациях.

Константа скорости реакций второго порядка


Используйте формулу k=1t(1[A]t−1[A]0)k = /frac{1}{t} /left( /frac{1}{[A]_t} - /frac{1}{[A]_0} /right)k=t1([A]t1−[A]01) для расчета константы скорости.

Лекция 146 Константа скорости электрохимической реакции
Запомните, что единицы измерения kkk для реакции второго порядка — моль⁻¹·л·с⁻¹.

5 2 Кинетические уравнения


Для точных расчетов используйте концентрации в молях на литр и время в секундах.

Лекция 2: закон действия масс, реакции первого и второго порядка (18.09.2019)


Графически проверьте линейную зависимость 1[A]/frac{1}{[A]}[A]1 от времени, чтобы подтвердить порядок реакции.
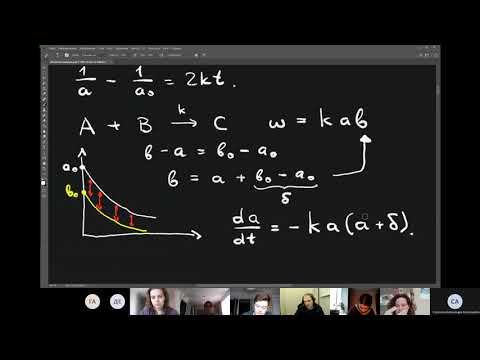
Лекция 4 -- 2021 -- Реакции второго и произвольного порядка. Упрощение кинетического уравнения


Всегда учитывайте влияние температуры на значение константы скорости реакции.

Если участвуют несколько реагентов, уточните, какой из них ограничивает скорость реакции.

ЛЕКЦИЯ №2 -- Химическая кинетика -- Скорость реакции, Закон действия масс, Порядок реакции

Избегайте ошибок в измерении начальных концентраций, так как это сильно влияет на результат.

Химическая кинетика
При необходимости используйте численные методы для решения сложных интегральных уравнений.

Проверьте правильность расчетов, сравнив их с экспериментальными данными.
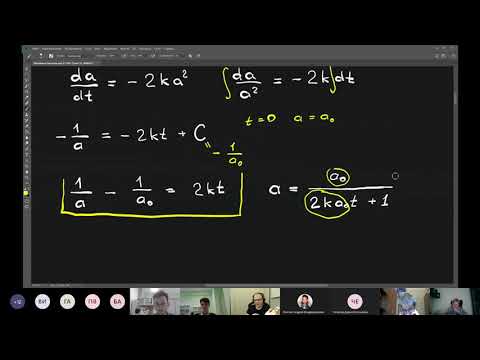
Кинетика -- Лекция 4 -- Реакции второго порядка, общий интеграл кинетического уравнения

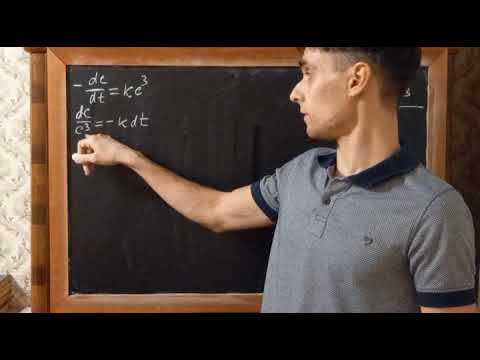
Константа скорости реакций третьего порядка