Таблицы и рекомендации по степени электролитической диссоциации
Страница содержит полезную информацию, таблицы и советы по определению степени электролитической диссоциации веществ. Узнайте больше о важности этого параметра и научитесь работать с данными.


Учитывайте температуру раствора, так как она влияет на степень диссоциации.

Понятие электролита. Сильные и слабые электролиты. Диссоциация. Степень диссоциации - Химия
Пользуйтесь таблицами растворимости, чтобы понять, как электролиты ведут себя в разных условиях.

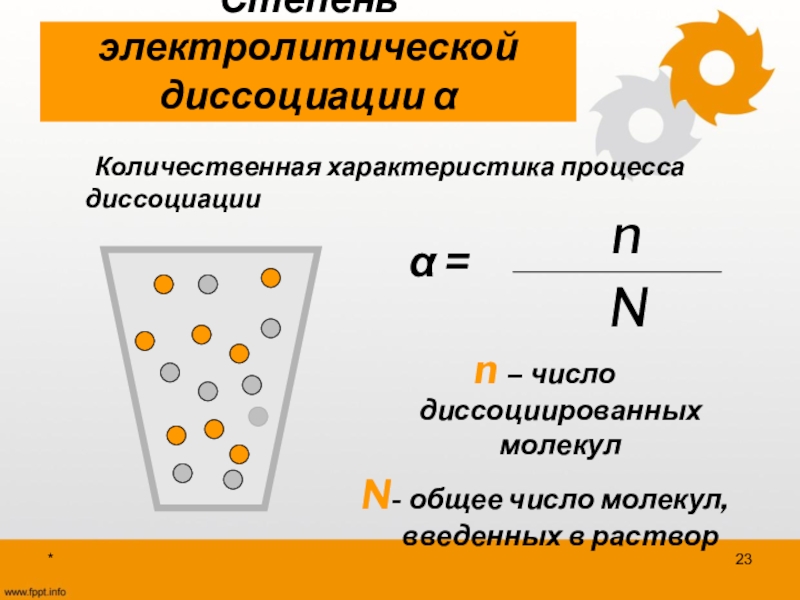
Степень диссоциации
Для сильных электролитов степень диссоциации близка к 1, что важно учитывать в расчетах.

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIV
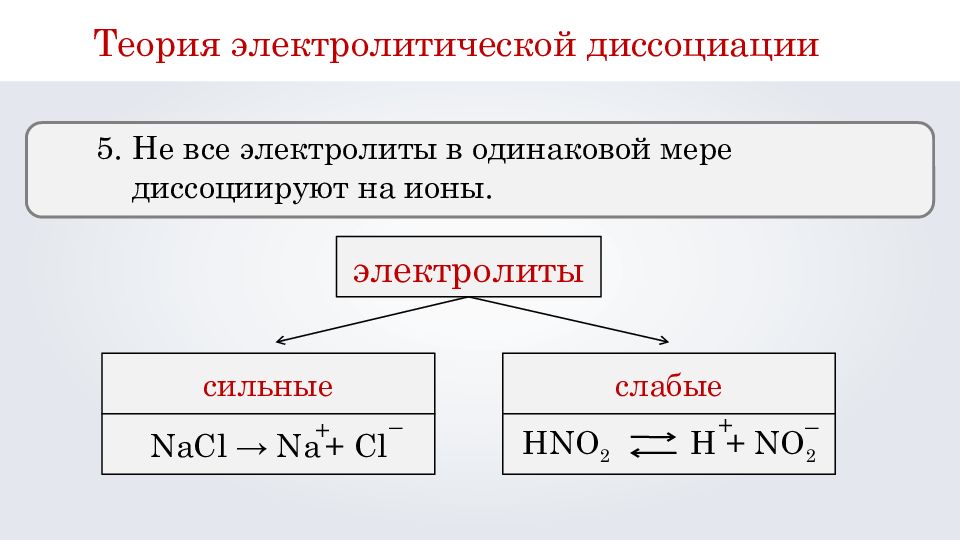
Помните, что слабые электролиты диссоциируют частично, это отражено в таблицах.
Электролитическая диссоциация кислот, оснований и солей. 9 класс.

Используйте формулу α = (n/N), где n — число диссоциированных молекул, а N — общее количество молекул.

Лекция: Диссоциация электролитов. Степень и константа диссоциации. Водородный показатель pH.
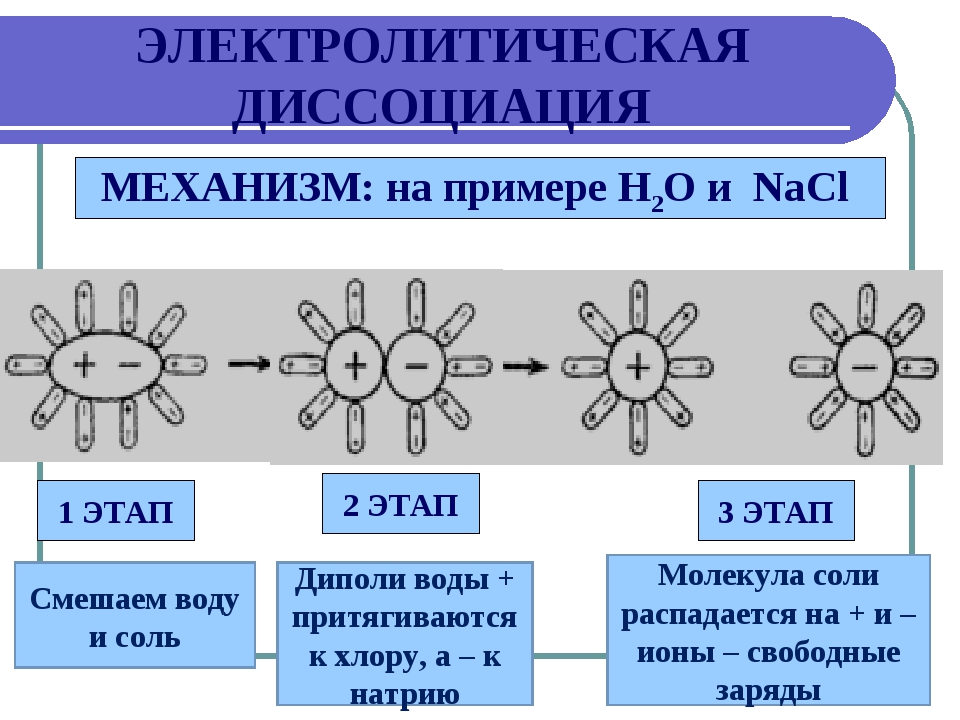
Обратите внимание на ионную силу раствора, она влияет на активность ионов.
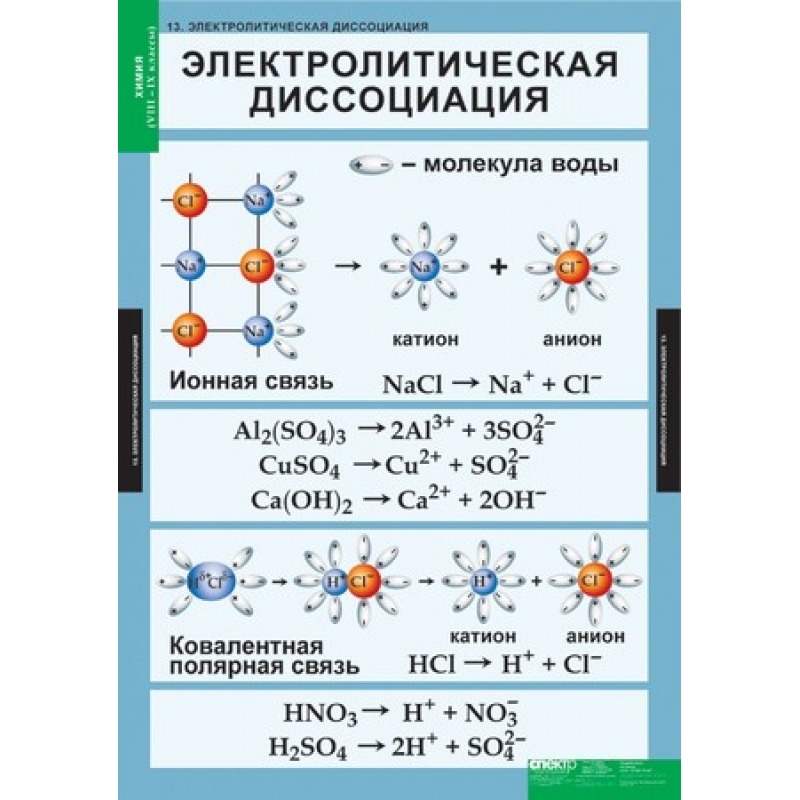

Сравнивайте результаты с экспериментальными данными для повышения точности расчетов.

Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.

При работе с концентрированными растворами учитывайте, что степень диссоциации уменьшается.
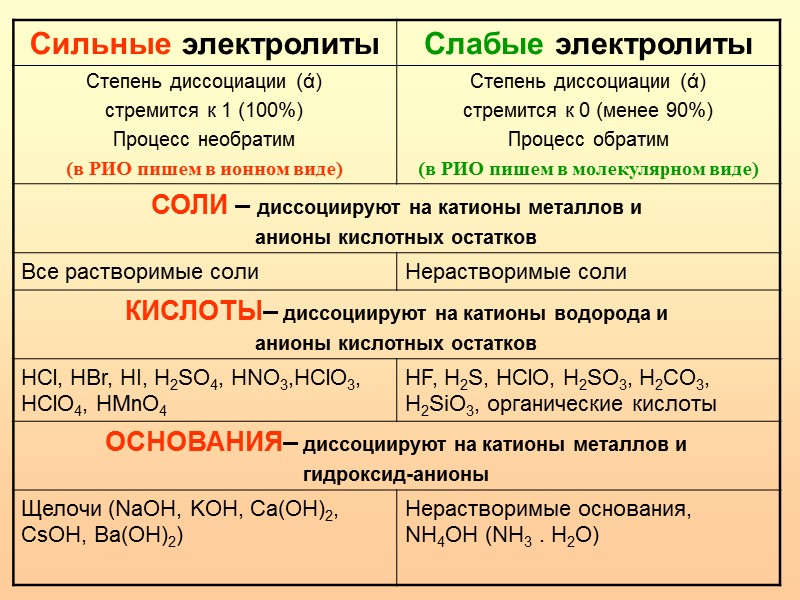
Используйте проводимость раствора для оценки степени диссоциации электролитов.

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей - Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙ

Обратитесь к справочной литературе для уточнения данных по редким соединениям.


РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по Химии