Основы заполнения электронных уровней: как понять структуру атома и его электронную оболочку
Заполнение уровней электронами в атомах — это важная тема в химии и физике, которая объясняет, как электроны распределяются по различным энергетическим уровням. Это знание необходимо для понимания химической структуры элементов, их реакционной способности и свойств. В этой статье мы собрали полезные советы и объяснения, которые помогут вам разобраться в этом процессе.
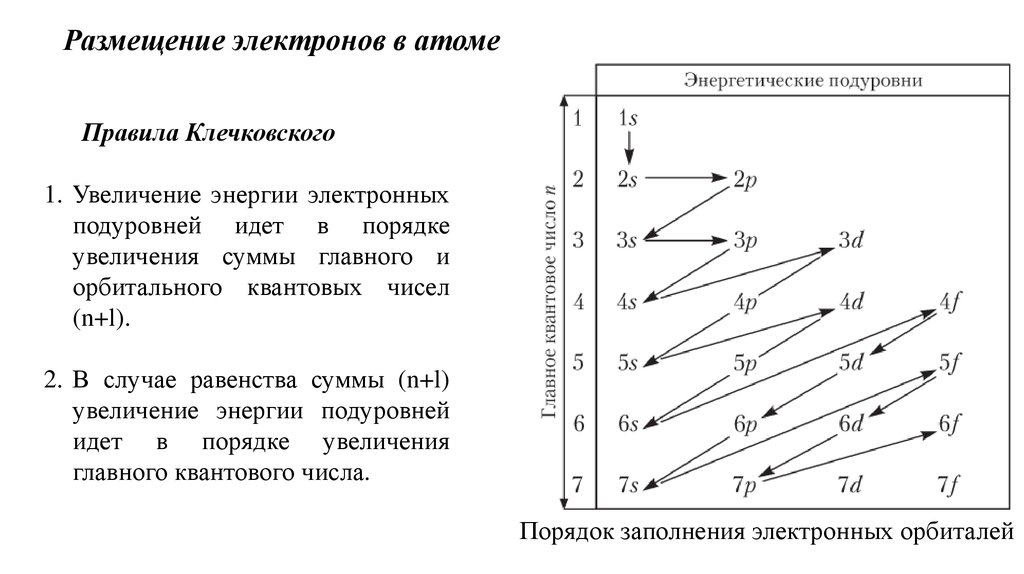

При изучении заполнения уровней электронами важно запомнить принцип минимальной энергии: электроны стремятся занять орбитали с наименьшей энергией.

Строение атома. Как составить электронную и электронно-графическую формулы?

Для правильного распределения электронов в атоме используйте правило Ауффбау: сначала заполняются более низкие энергетические уровни.

Движение электронов в атоме. 1 часть. 8 класс.

Не забывайте об исключении принципа Паули, который утверждает, что на каждой орбитали не может находиться больше двух электронов с противоположными спинами.

Энергетические уровни. 8 класс.

Правило Хунда говорит, что электроны в подуровнях распределяются так, чтобы максимизировать количество одноименных спинов перед их парованием.

ВСЯ ТЕОРИЯ для задания №1: строение атома, электронные конфигурации I Химия ЕГЭ I Умскул

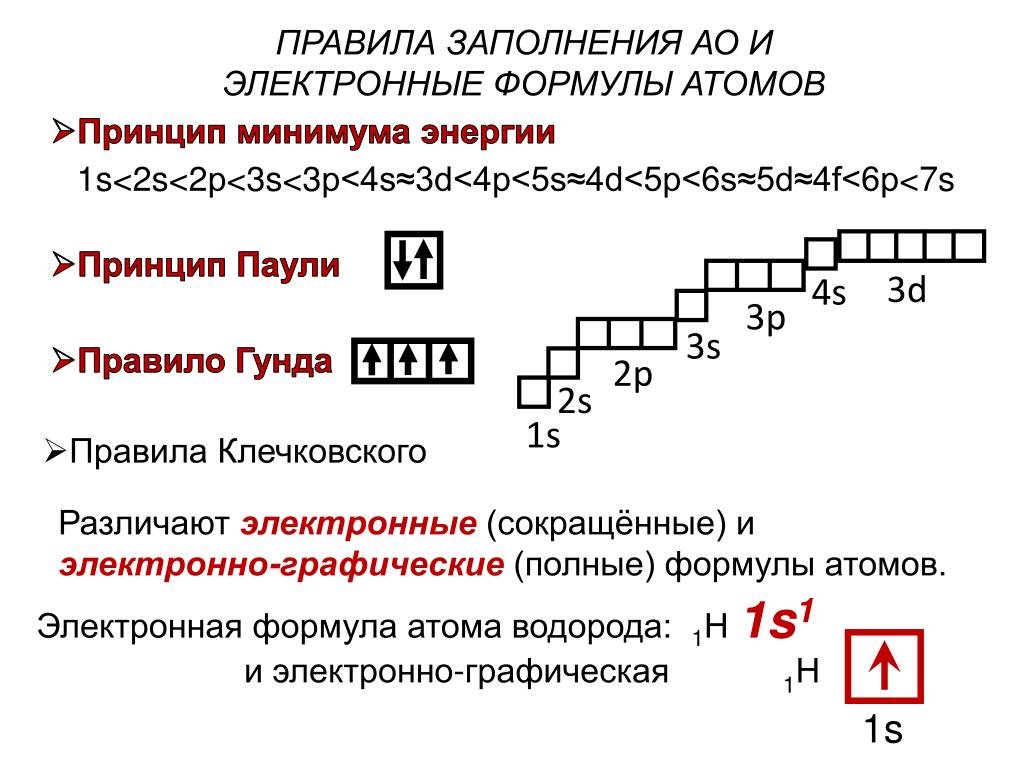
Понимание периодической таблицы элементов помогает легко определить количество электронов на каждом уровне, основываясь на атомном номере элемента.

ШОК у родителей от общения с Уполномоченным по правам ребенка/защитой здесь и не пахнет #рамкишкола

Заполнение внешних уровней (валентных электронов) особенно важно для объяснения химических реакций и валентности атомов.
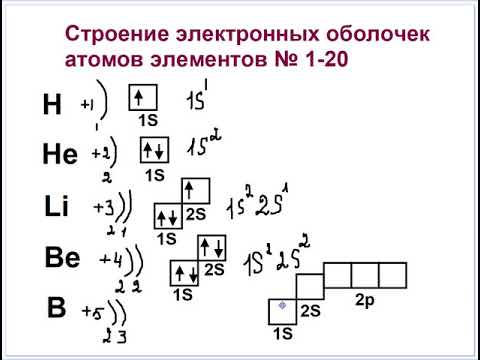
Строение электронных оболочек элементов 1-20


Каждое заполнение уровня электронами связано с определенным числом орбиталей: s-орбиталь может вмещать 2 электрона, p-орбиталь — 6, d-орбиталь — 10, f-орбиталь — 14.
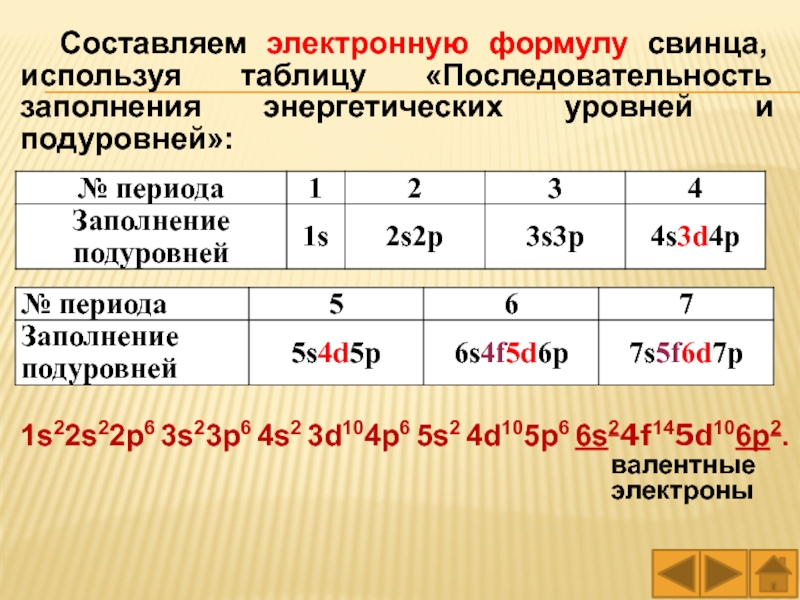

Важно помнить, что на более высоких уровнях заполняются не только более сложные орбитали, но и их энергия выше, что влияет на свойства атомов.
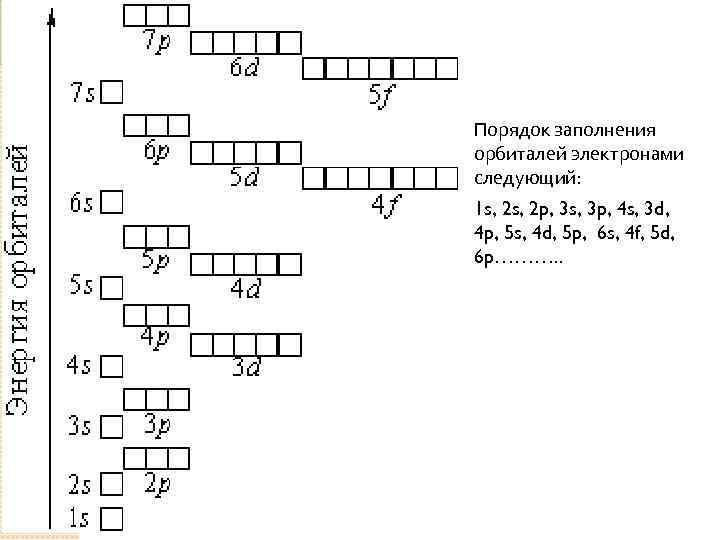
Используйте электронную конфигурацию для анализа химической активности атомов и их возможных соединений с другими элементами.

Когда вы определяете распределение электронов, всегда проверяйте соблюдение основных принципов: принципа Паули, Хунда и Ауффбау.


8 класс. Распределение электронов в атоме. Электронные формулы.